“‘间谍’不仅潜入城堡内部,并且能够操纵城堡工匠,制造出新的武器,用于精准识别并清除城堡守卫,从而破坏防御系统,使得城堡沦陷。”
这可不是童话故事,而是存在于病毒和宿主细胞间的真实“战事”。
近日,中国科学院大学(以下简称“国科大”)博士生导师、中国科学院武汉病毒研究所(以下简称“武汉病毒所”)研究员彭珂、曹晟团队在Cell上发表了题为“Rift Valley fever virus coordinates the assembly of a programmable E3-ligase to promote viral replication”的研究论文。该研究揭示了裂谷热病毒非结构蛋白NSs重塑宿主E3泛素连接酶系统性抑制宿主抗病毒免疫的致病新机制。国科大2021级生物化学与分子生物学专业博士生李慧玲,武汉病毒所实验师张玉兰、饶桂波为共同第一作者。
 Cell论文页面
Cell论文页面
裂谷热病毒(Rift Valley fever virus, RVFV)是一种蚊媒传播的病原体,是导致裂谷热(Rift Valley fever, RVF)的罪魁祸首。该病毒不仅能够引发动物感染性流产,还可在人体中引起脑炎或出血热等严重疾病,重症感染者具有较高的病死率。RVFV的传播途径包括蚊子叮咬、接触感染动物的血液或器官,这使得病毒能够跨越地理障碍,扩散至新的地区。目前,RVFV感染致病的关键机制尚不清楚,这阻碍了针对裂谷热病毒抗病毒药物的研发。
全新的机制
如果将宿主细胞比喻成城堡,RVFV则可以被比喻成入侵者。城堡有自己的守卫部队(转录因子复合物IIH,TFIIH)和城墙(IFN-I干扰素免疫通路相关基因),共同构成防御系统(抗病毒免疫反应)来抵御入侵者。
RVFV的非结构蛋白NSs就像是一个狡猾的“间谍”,它能够潜入城堡内部,并且操纵城堡的工匠(宿主E3泛素连接酶组分FBXO3)制造出一种新的武器(纤维状FBXO3-NSs泛素连接酶)。这个新武器能够精确地识别并清除城堡的守卫部队(TFIIH复合物),没有了守卫部队的维护,城墙(IFN-I干扰素免疫通路)便无法得到及时的修复和加固,城堡逐渐变得脆弱,无法抵抗入侵者的进一步侵袭。这样,病毒就能够在宿主细胞内自由地复制和扩散,最终完全占领并侵袭更多的宿主细胞。
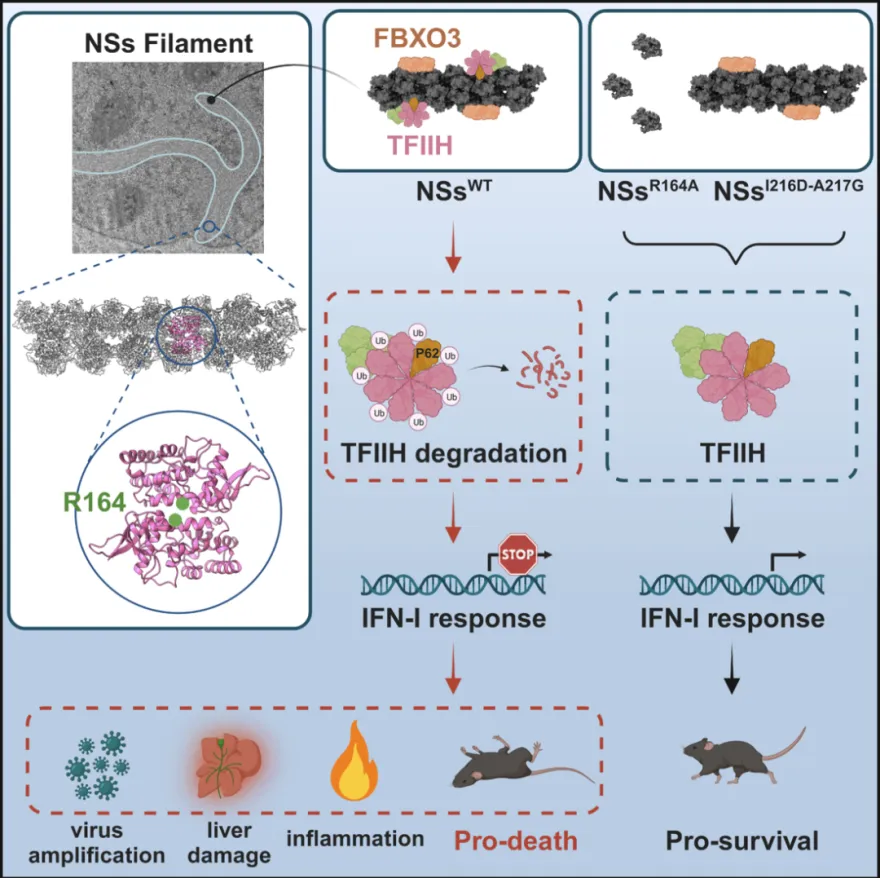 文章模式图:NSs蛋白重塑的FBXO3-NSs filament介导TFIIH复合体降解,系统性拮抗宿主IFN-I反应,促进RVFV感染致病
文章模式图:NSs蛋白重塑的FBXO3-NSs filament介导TFIIH复合体降解,系统性拮抗宿主IFN-I反应,促进RVFV感染致病
基于此研究,未来有望将NSs改造成为蛋白靶向降解的分子机器,可广泛应用于生物医学及转化的相关研究。与此同时,该研究也为针对NSs蛋白开发新型特异性抗病毒药物提供了理论基础。
成果与成长
病毒作为一种严格寄生性的生命形式,是如何在长期的自然选择和进化过程中利用宿主细胞完成自身的复制增殖和传播的?
李慧玲和团队成员不断探索着这个难题。
“每次想到能探索未知,揭开病毒的一点小秘密,我就很兴奋,就像开盲盒一样,特别有意思。”在本次研究中,李慧玲主要负责细胞水平及小鼠模型中的机制探究版块,参与完成实验方案设计、开展实验验证、研究方案调整和实验数据分析等工作。
回想起在实验室里的工作情况,李慧玲依然历历在目。
“从武汉病毒所郑店园区出发,一个小时车程到达小洪山园区。进入P3实验室连续作业3至4个小时,若是遇上解剖取材,则需要花费更长时间。”这样的日复一日,李慧玲已经习以为常。
“为保证安全操作,我们的精神必须高度集中,每一步都要谨慎进行。”正是这些磨练与考验,让李慧玲深刻意识到严谨的重要性,也因此对实验工作肩负起了更加坚定的责任感。
 团队在讨论研究内容(从左至右分别为张玉兰、饶桂波、彭珂、李慧玲、曹晟)
团队在讨论研究内容(从左至右分别为张玉兰、饶桂波、彭珂、李慧玲、曹晟)
“做有原创性、普适性、重要性的科研,是我们一直的学术追求。”保持好奇心和求知欲、不畏惧挫折和失败、注重团队协作,李慧玲和团队成员们在课题推进中,“逢山开路、遇水搭桥”,不断收获成长。
李慧玲也希望,未来能继续探究病毒的致病机制,并将研究成果转化为实际应用,为社会带来实实在在的价值。
 团队合照(中排左二为彭珂,前排右二为李慧玲)
团队合照(中排左二为彭珂,前排右二为李慧玲)
病毒,作为自然界中最简单的生命形式之一,它们的存在和演化对生态系统的平衡至关重要。然而,当病毒跨越物种界限,侵入人类社会,人类与其的博弈便开始了。
RVFV的研究成果振奋人心,但人类与病毒的博弈持久永恒。此刻,团队已经开始了“过关斩将”的新征程。
本文链接:http://knowith.com/news-2-1718.html国科大团队揭示病毒致病新机制
声明:本网页内容由互联网博主自发贡献,不代表本站观点,本站不承担任何法律责任。天上不会到馅饼,请大家谨防诈骗!若有侵权等问题请及时与本网联系,我们将在第一时间删除处理。