癫痫是全球最常见的神经系统疾病之一,患者数量达数千万,其中近三分之一属于药物难治性癫痫——其发作无法通过现有抗癫痫药物有效控制。因此,深入探寻癫痫发作的核心机制、发掘新的干预靶点至关重要。
神经元异常同步放电是癫痫发作的核心病理表现。如果我们在神经元电发放的源头加以控制,将能高效地抑制异常放电的产生。神经元电发放始于轴突起始段(axon initial segment, AIS),该处分布着密集的钠离子通道,是动作电位起始爆发的区域。在众多抑制性神经元中,吊灯样细胞(chandelier cells, ChCs)的轴突末端直接支配在AIS,一个吊灯样细胞可以广泛支配数百乃至上千个的下游兴奋性神经元。理论上具备以一控百、高效抑制网络兴奋性的独特优势。早在上世纪末,癫痫的“吊灯样细胞假说”就被提出,该假说认为,人群中吊灯样细胞支配数量的差别可能决定了个体癫痫易感性的不同。但长久以来,由于研究手段的匮乏,这一假说一直未能得到实验证据的支持。
近日,复旦大学脑科学研究院邰一琳、倪剑光团队在《先进科学》(Advanced Science)在线发表题为“Hippocampal Chandelier Cells Modulate Seizure Susceptibility and Severity(海马吊灯样细胞调控癫痫发作易感性与严重度)”的研究论文。该研究综合利用新型遗传学工具、在体钙信号记录、化学遗传学干预及形态学分析等手段,发现海马CA1区ChCs在癫痫发作时对网络过度激活做出了响应。进一步实验证实,抑制ChCs活动会增加癫痫易感性并加剧癫痫发作,而激活其活动则能缓解症状。系统地阐明了海马CA1区ChCs在癫痫发作中起到的内源性保护作用。
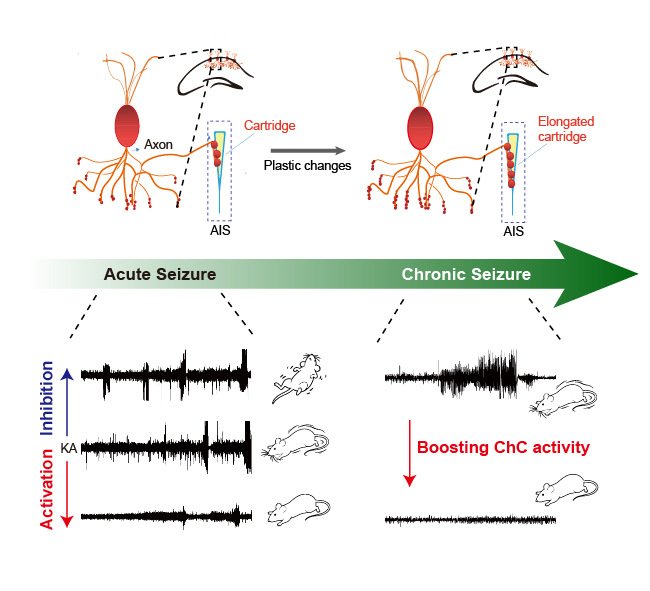
研究团队首先通过在体钙信号记录发现,癫痫发作期间,海马ChCs被募集,其钙活动在癫痫发作期骤然增强。随后,研究人员阻断了ChCs向AIS的GABA能输出。由于兴奋性神经元在AIS处失去了抑制性神经递质GABA的来源,小鼠中出现了自发性癫痫样放电;而在药物诱导的急性癫痫模型中,小鼠则表现出癫痫发作潜伏期的缩短、发作频率的增加,说明ChC对维持网络稳态至关重要。相应地,双向化学遗传学操控表明,抑制ChCs活性会加剧癫痫表型,而激活ChCs则能有效降低癫痫易感性。尤为重要的是,在慢性癫痫阶段,激活ChCs仍能显著减少自发性复发癫痫(SRS),抑制癫痫的反复发作,揭示了其持久的治疗潜力。此外,研究在形态学层面观察到,在癫痫发生后,ChCs的轴突突触 boutons 数量增多,表明其存在显著的结构可塑性,说明在大脑处于过兴奋状态后,ChCs会主动代偿性增加抑制性信号的输出。相较于其他抑制性中间神经元在癫痫发生后大量死亡的表现,ChCs的这种代偿性增强的现象,为癫痫的治疗提供了有效的干预靶点。
本研究首次在体直接证实:海马ChCs在急性和慢性癫痫中均发挥着内源性抗癫痫的关键作用。这不仅为癫痫的“吊灯样细胞假说”提供了确凿证据,更揭示了增强ChCs活性可作为癫痫干预的潜在细胞靶点,尤其为药物难治性癫痫的治疗突破提供了新方向。
复旦大学脑科学研究院邰一琳研究员为最后通讯作者,上海交通大学医学院吕江腾研究员与复旦大学脑科学研究院倪剑光研究员为共同通讯作者。复旦大学脑科学研究院李洋博士后、田冀丰博士研究生、魏嘉璠硕士研究生与王倩芸博士研究生为该论文的共同第一作者。研究工作得到了国家自然科学基金等项目的资助。
原文链接:https://doi.org/10.1002/advs.202501066
本文链接:http://knowith.com/news-3-4364.html脑科学研究院邰一琳、倪剑光课题组揭示癫痫发作新机制,为癫痫治疗提供新的细胞靶点
声明:本网页内容由互联网博主自发贡献,不代表本站观点,本站不承担任何法律责任。天上不会到馅饼,请大家谨防诈骗!若有侵权等问题请及时与本网联系,我们将在第一时间删除处理。
